Wasser: Unterschied zwischen den Versionen
| Zeile 18: | Zeile 18: | ||
|} | |} | ||
<br style="clear:both" > | <br style="clear:both" > | ||
| − | Im 'festen' Zustand sind die Moleküle des Wassers nahezu unbeweglich an einen festen Platz gebunden. Es bestehen feste Bindungen zwischen den Molekülen. | + | Im ''festen'' Zustand sind die Moleküle des Wassers nahezu unbeweglich an einen festen Platz gebunden. Es bestehen feste Bindungen zwischen den Molekülen. |
| − | Im 'flüssigen' Zustand haben die Moleküle ausreichend Energie, um sich zu bewegen/verschieben. Verbindungen zwischen den Molekülen sind nicht permanent. Jedoch sind die Kräfte zwischen den Molekülen noch so groß, dass die Moleküle die Wasseroberfläche nicht verlassen können. | + | Im ''flüssigen'' Zustand haben die Moleküle ausreichend Energie, um sich zu bewegen/verschieben. Verbindungen zwischen den Molekülen sind nicht permanent. Jedoch sind die Kräfte zwischen den Molekülen noch so groß, dass die Moleküle die Wasseroberfläche nicht verlassen können. |
| − | Im 'gasförmigen' Zustand haben die Moleküle soviel Energie, dass sie die Bindungen zu den benachbarten Molekülen brechen. | + | Im ''gasförmigen'' Zustand haben die Moleküle soviel Energie, dass sie die Bindungen zu den benachbarten Molekülen brechen. |
===Gefrierpunkt=== | ===Gefrierpunkt=== | ||
Version vom 29. August 2013, 17:56 Uhr
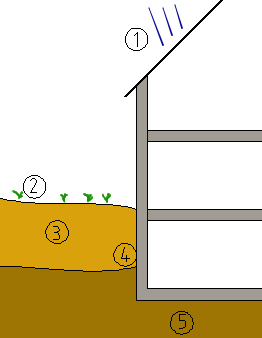
Wasserarten am Bau
Wasser kommt in folgenden Formen am Bau vor:
- Niederschlag (Regen, Schnee, Tau usw)
- Oberflächenwasser
- Sickerwasser
- Stauwasser
- Grundfeuchte/Grundwasser
Aggregatszustände
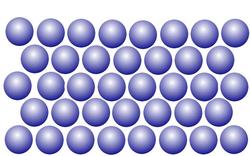
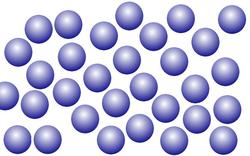
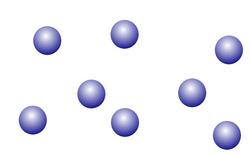
Wasser kommt in den sogenannten drei Aggregatszuständen fest, flüssig, gasförmig vor. Umgangssprachlich spricht man von Eis, Wasser und Wasserdampf.
Im festen Zustand sind die Moleküle des Wassers nahezu unbeweglich an einen festen Platz gebunden. Es bestehen feste Bindungen zwischen den Molekülen.
Im flüssigen Zustand haben die Moleküle ausreichend Energie, um sich zu bewegen/verschieben. Verbindungen zwischen den Molekülen sind nicht permanent. Jedoch sind die Kräfte zwischen den Molekülen noch so groß, dass die Moleküle die Wasseroberfläche nicht verlassen können.
Im gasförmigen Zustand haben die Moleküle soviel Energie, dass sie die Bindungen zu den benachbarten Molekülen brechen.
Gefrierpunkt
In unseren Breitegraden 0°C. Bei dieser Temperatur gefriert Wasser. (Nicht zu Verwechseln mit dem Taupunkt).
Siedepunkt
In unseren Breitegraden ist der Siedepunkt 100°C
Verdampfung
Übergang des Wassers vom flüssigen in den gasförmigen Zustand bei beliebigen Temperaturen unter 100°.
Kondensation
Übergang des Wassers vom gasförmigen in den flüssigen Zustand unter 100°
Frostpunkt
Temperatur, bei der Wasser gefriert. Wasser vegrößest dabei sein Volumen. Legt man also z.B. eine mit Wasser gefüllte (Glas-)Flasche in eine Tiefkühltruhe, so zerspringt die Flasche. Ebenso zerstört Wasser ein Deckmaterial, wenn es z.B. in Haarrisse oder Fugen eingedrungen ist.
Wasserkreislauf
Man unterscheidet beim Wasser den natürlichen und den künstlichen vom Menschen geschaffenen Wasserkreislauf.
natürlicher Wasserkreislauf
[Darstellung der natürlichen Wasserkreislaufs.]
- Verdunstung
- Wolkenbildung
- Regen
- Wasserläufe
- Meer
künstlicher Wasserkreislauf
[Darstellung des künstlichen Wasserkreislaufs]
- Aufbereitung
- Verbrauch
- Klärung